はじめに
では,
ここで.
これまでパーキンソン病(Parkinson’s disease: PD)は、主に中脳黒質の神経細胞の変性によって起こる「脳の病気」として知られてきました。しかし、2025年に中国・武漢大学の研究チームが発表した内容は、この定説に新たな視点を投げかけるものでした。彼らは、パーキンソン病の原因となる異常タンパク質「α-シヌクレイン」が、実は腎臓での処理に失敗することで蓄積・伝播し、最終的に脳に到達する可能性があるという新説を示したのです。
本記事では、最新研究に基づき、「腎臓」と「パーキンソン病」の深い関係、特に慢性腎臓病(CKD)の患者がPDリスクを高める可能性について詳しく解説します。
α-シヌクレインとは?パーキンソン病の病理の中心
パーキンソン病の発症には、「α-シヌクレイン(α-synuclein)」というタンパク質の異常蓄積が深く関わっています。このタンパク質は本来、神経細胞のシナプスで神経伝達を調整する役割を担っていますが、何らかの要因で誤った立体構造(折りたたみ異常)をとると、細胞内で凝集し「レビー小体」と呼ばれる封入体を形成します。レビー小体の蓄積は、神経細胞死を引き起こし、パーキンソン病の運動症状(震え、筋固縮、無動、姿勢保持障害)に直結します。
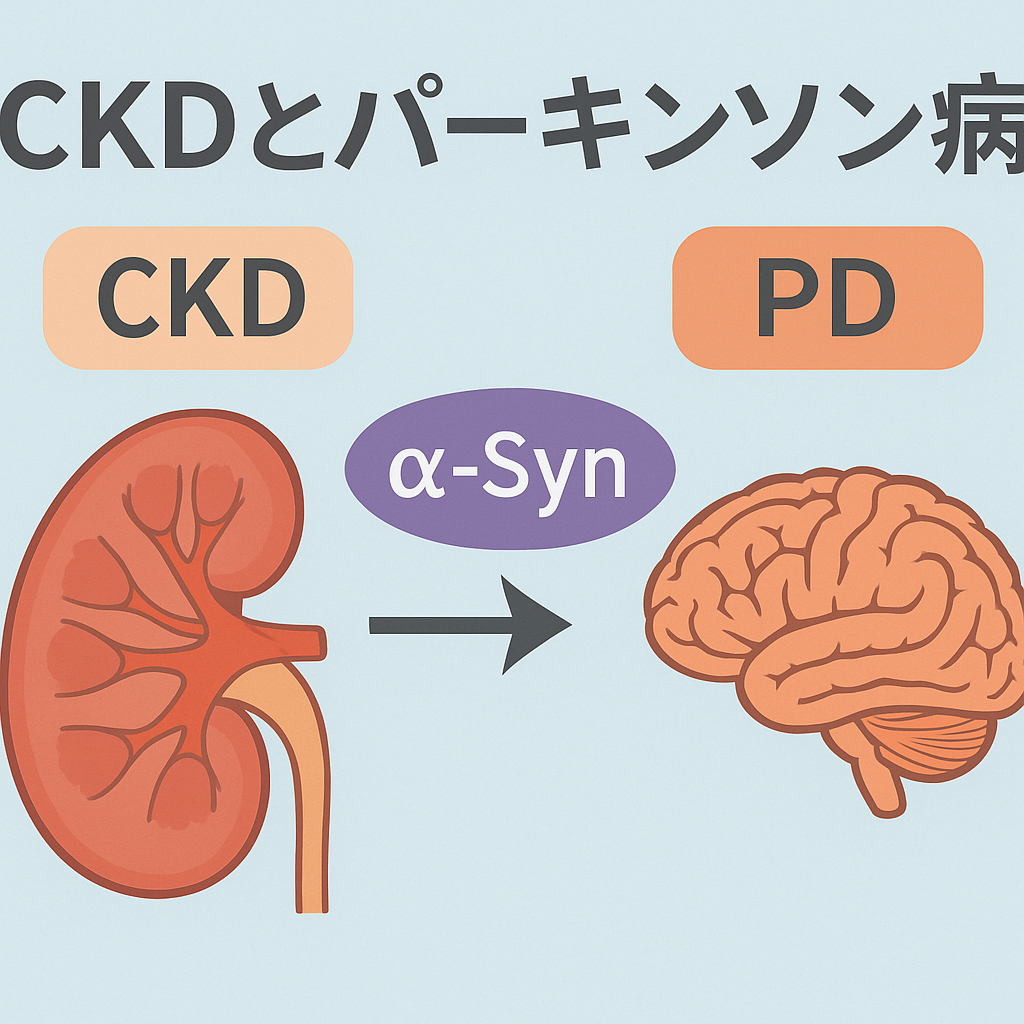
これまでは、このα-synが腸や嗅球から脳に向かって病的に広がっていくという「腸起源仮説」や「嗅球起源説」が有力とされていました。しかし、武漢大学の研究は、**「腎臓起源説」**を提示し、臓器間のつながりに注目が集まっています。
また、α-synは中枢神経だけでなく赤血球にも豊富に含まれており、特に骨髄移植実験により、赤血球が血中α-synの主要な供給源であることが示されています。これは、α-synが赤血球膜の構造や代謝環境に安定して存在し得る特性を持っているためと考えられています。
腎臓とα-シヌクレイン:分解・クリアランスの場としての役割
研究チームが着目したのは、腎臓の**「分解機能」**です。従来、腎臓は糸球体による「ろ過」と尿への「排泄」に注目されがちでしたが、近位尿細管細胞が血中タンパク質を能動的に取り込み、リソソームで分解するという代謝臓器としての側面があります。
研究では、α-synが主に赤血球由来であること、血中ではアルブミンなどと結合しており尿にほとんど出てこないことを確認したうえで、腎臓の近位尿細管が血中α-synを取り込み、分解していることを明らかにしました。マウス実験では、α-synを静脈注射した後、腎臓の尿細管に顕著な蓄積が確認され、リソソームマーカー(LAMP1)と共局在していたことが報告されています。
また、同研究では骨髄移植モデルを用い、赤血球由来のα-synを欠損させたマウスでは腎臓や脳内のα-syn蓄積が大幅に減少し、パーキンソン病様症状も緩和されることが示されました。これにより、赤血球がα-synの主要な供給源であることも実証されました。
このように腎臓は「体内のα-synの掃除屋」として働いていることが、実験的に裏付けられています。
CKDではα-synの処理が破綻する
武漢大学の研究では、α-synが腎臓で処理されない場合に中枢神経系へ伝播する経路として、腎神経(renal nerves)を介した逆行性軸索輸送が関与していることも明らかにされました。具体的には、腎臓に蓄積したα-synが、感覚神経を通じて脊髄、さらに脳へと広がっていく様子がマウスモデルで観察されています。
さらに、腎神経を切断したマウスでは脳内へのα-synの蓄積が大幅に抑制されたという実験結果が得られており、これにより「腎臓→脳」という新たな伝播ルートの存在が実証されました。
では、腎臓に障害がある場合、どうなるのでしょうか。
慢性腎臓病(CKD)では、単にろ過機能(GFR)が低下するだけではなく、尿細管細胞の再吸収・代謝能力も損なわれることが知られています。CKDマウスモデルでは、α-synが腎臓内に蓄積し、その処理能力が低下していることが明らかになりました。さらに興味深いのは、腎臓に蓄積したα-synが、腎神経を介して脊髄→脳へと逆行性に伝播するルートが実証されたことです。
これは、α-synの「腎臓発 → 中枢神経系へ伝播」というまったく新しい経路であり、腎神経を切断すると脳への伝播が抑制されたという結果も報告されています。
透過されないα-synがなぜ分解されるのか?
この研究で特に驚きなのは、α-synは糸球体でほとんどろ過されないにもかかわらず、腎臓で分解されている点です。これは、血中α-synが「尿細管周囲の毛細血管」から「近位尿細管細胞」に基底膜側から能動的に取り込まれていることを意味します。
尿細管細胞には、アルブミンや結合型タンパク質を選択的に取り込む受容体(例:megalin, cubilin)が存在し、こうした経路を通じて血中α-synも処理対象になることが示唆されています。ろ過されないから処理されない、というわけではないのです。
CKD患者にパーキンソン病が多いという疫学的背景
臨床疫学の面からも、腎機能の低下とパーキンソン病の関連性は報告されています。
- eGFR(推算糸球体濾過量)が低い高齢者では、PDの発症リスクが有意に高まることが複数のコホート研究で示されています。
- CKD患者におけるα-synの血中濃度は健常人より高い傾向があるとする報告もありますが、非運動症状との直接的な相関については今後の検証が必要です。
これは、単なる「共通の高齢化リスク」だけでは説明がつかず、腎機能の低下が直接的にα-syn代謝に影響し、中枢神経へ波及している可能性を強く示唆しています。
新たな治療ターゲットとしての腎機能
この発見は、パーキンソン病の治療と予防において、腎機能が極めて重要な役割を果たす可能性を示しています。今後は以下のような展開が期待されます:
- 血中α-synとeGFRを組み合わせた早期診断マーカーの開発
→ 脳症状が出る前に「腎由来α-synリスク」を評価できる。 - 腎臓機能をサポートする治療(抗酸化、抗炎症)によるPD予防
→ 特にCKD進行を防ぐことが神経保護につながる可能性。 - α-syn除去療法(抗体、吸着、血液浄化)と腎代謝機能の併用治療
→ 蓄積リスクを複合的に低減。
おわりに:腎臓を守ることが脳を守る時代へ
これまで「脳の病気」として研究されてきたパーキンソン病が、実は「全身性の代謝障害」から始まる可能性があるという視点は、非常に革新的です。特に腎臓は、静かに体内の老廃物や毒素、さらには異常タンパク質の代謝に関与していることが再評価されつつあります。
CKDとPDの関係を理解することは、腎臓を守ることが脳を守るという新しい予防医学の地平を開くものです。高齢化が進む日本において、今後ますます重要な視点となることでしょう。
(参考文献:Zhang et al., Nature Neuroscience, 2025年、PubMed ID: 39849144)
2025/06/29